はじめに
栄養分と抗体を豊富に含む初乳は、生まれたばかりの子牛に受動免疫を与えるために不可欠です。初乳中の免疫グロブリン G(IgG)濃度は、初乳の品質を決定する重要な要素であり、初乳中の IgG 濃度を間接的に測定する方法として、牧場では Brix 屈折率測定法が一般的に用いられています。子牛が病気に対する抵抗力をつけるためには、初乳が重要な役割を果たすからです(図 1)。しかし、母牛の初乳の質は同じ牛群内でも牛によって大きく異なることがあります。このような背景から、初乳補 充剤で母牛の初乳を濃縮することは、IgG、栄養素、生理活性化合物の濃度を増や して品質を向上させる効果的な戦略として浮上してきました。
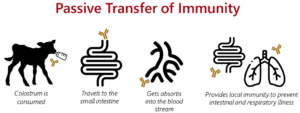
図1.新生子牛における受動免疫の伝達メカニズムを図式化したもの。
母体初乳のBrix %と変動性
初乳が高品質とみなされるには、IgG 濃度が 50g/L 以上でなければならない(McGuirk and Collins, 2004)。初乳の品質を農場で測定する実用的で、迅速かつ費用対効果の高い方法は、屈折計を使 用することです(Bielmann et al.)屈折計は IgG 濃度を直接測定する代わりに、初乳の総タンパク質含量を評価し、% Brix で表示します。初乳中の % Brix と IgG 濃度との相関は、特に分娩後数時間は非常に高い(Quigley et al.)研究によると、Brix が 22% 以上であれば、一般的に良質な初乳であり、免疫の受動 的移行を確実にし(Quigley et al.この点から、仮に体重 40kg の子牛に Brix 22% の初乳を 4 リットル与える場合、200g の IgG を与えることになる。
ホルスタイン種の子牛には、体重の 10%(.1 x 40 = 4L)、Brix 22%(50g IgG/L x 4 = 200g の IgG)の初乳を与えるべきであり、これは長年に わたって一般的なガイドラインとなっています。しかし、新しい推奨事項では、初乳により多くの抗体(IgG)を与えること で、子牛の罹病率および受動的移行失敗率が減少することが示されています。この新しい推奨事項では、優れた受動的移行を達成するために、 300g の IgG を与えることを推奨しています。Brixの観点からは、これは何を意味するのでしょうか?つまり、24% よりも高い Brix レベルの初乳を選択するために、農場の基準を引き上げる必要があるということです。しかし、牛群内の初乳の品質を一定に保つことは非常に難しく、同じ牛群内でも牛によって大きなばらつきが生じる条件があるからです。このばらつきは、年齢、品種、栄養状態、分娩前ワクチ ン接種、乳量、分娩から初乳採取までの間隔などの要因に影響される(Moore ら、 2005; Conneely ら、2013)。米国の 8 酪農場で実施された研究(図 2)では、母乳初乳中の IgG 濃度を屈折計で分析した結果、Brix パーセンテージは 12% から 32% までの幅があり、平均は 23.8% であったことから、牛によって IgG 濃度に大きなばらつきがあることがわかる(Quigley et al.)Quigley ら(2013)のこの研究は、子牛の IgG を適切に受動移行させるために、母 牛の初乳のみに頼ることの難しさを浮き彫りにしている。
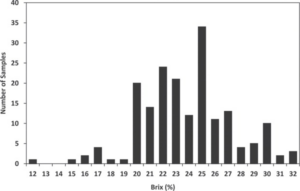
図2.Quigley ら(2013)より引用。Brix レフラクトメトリーで推定した母体初乳中の総タンパク質の分布
このようなばらつきに対処し、母体初乳の質を向上させるために、初乳補 充剤を使用するのが効果的な戦略である。この戦略は、酪農場で入手できる母牛初乳の質の差に起因する制限を克服し、子牛の免疫発育に不可欠な抗体の移行をより一貫したものにする、実行可能な代替策となる。
低品質の母体初乳を強化する利点
濃縮プロセスでは、正確な量のコロストラムレプリサーを母牛の初乳に直接添加します。こうすることで、母体の初乳のBrixパーセンテージが低く、例えば15%から24%の間で、より高い品質のパーセンテージにしたい場合、IgGレベルが一定している初乳補充液で濃縮することができます。 いつ、なぜ母体の初乳を濃縮する必要があるのか?
- 母体初乳の免疫学的質を高める。
- 牛群内の初乳品質のばらつきを減らす。
- 初乳の搾乳が遅れている場合。病原体からの幅広い防御
- 極寒または極暑の気候条件下で、子牛の体温調節を改善する。
- 子牛の時:
- 初産の未経産牛が生まれる。
- 栄養状態の悪い牛から生まれる。
- 体が小さく、出生体重が低い。
- IgG吸収の見かけ上の効率低下による難産(帝王切開)の場合(Murrayら、2015年)。
- 遺伝的価値の高い子牛の場合。
母体初乳を濃縮することの有用性を裏付ける科学的証拠がある。カナダで実施された研究では、低品質の母体初乳をウシ初乳補液で濃縮し、新生子牛の血清 IgG 濃度を適切なレベルにできるかどうかが調査された(Lopez et al.、2023)。
この研究では、Brix 含量 15.8%(IgG 30g/L に相当)の母牛初乳を給与し、平均血清 IgG 濃度 11.76g/L を達成した(図 3)。この IgG 濃度は、最新の受動的免疫移行分類スケール(Lombard et al.)その後、母牛の初乳に 551 g のコロストラムレプリケーサー(カナダ、SK 州サスカトゥーン、SCCL)を添加し、IgG 濃度を 60 g/L まで引き上げた。母牛の初乳 + 代用初乳の組み合わせを給与した子牛の血清 IgG 濃度は平均 19.85 g/L で、Lombard ら(2020)の受動的免疫移行スケールでは「可 能」から「良好」のカテゴリーに移行した。さらに、Brix が 15.8% の母牛初乳を給与した子牛のうち、18.8% が受動免疫の移行に失敗した。しかし、その初乳をコロストラムレプリケーサーで濃縮すると、0% の子牛が受動免疫に失敗した (Lopez et al., 2023)。ブラジルで実施された別の同様の研究では、子牛に 25% Brix の母体初乳、または初めは 20% Brix であったが、コロストラム補充剤(Saskatoon, SK, Canada; SCCL)を用いて 25% Brix に濃縮した母体初乳を与えた(Silva et al.)
本試験の最終結果では、血清 IgG 濃度、血清総タンパク質、見かけの IgG 吸収 効率、濃厚飼料摂取量、1 日の体重増加量、体重、子牛の健康状態に関連する変数に関 して、子牛間に差は見られなかった。 
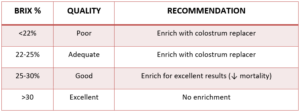
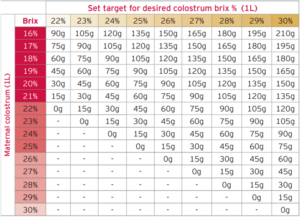

図3.Lopez他(2023)より改変。
これらの結果は、血清 IgG 値、健康状態、子牛の生産性に両試験で差がなかったこと から明らかなように、初乳補充剤による母牛初乳の品質向上が可能であることを示してい る。SCCL では、牧場での初乳の濃縮に関して一連の推奨事項があります。Brix パーセンテージが 22% 以下の初乳は、適切な IgG 量を得るために濃縮する必要があると考えられている。表 1 に、Brix パーセントによる初乳の分類と、それに対応する推奨事項を示す。
表 1.初乳補充剤による母体初乳の強化に関する推奨事項。
母牛の初乳に補充するコロストラムの量を正確に知るには、まず初乳のBrixパーセンテージを知る必要があります。これは屈折率計を使って行うことができ、初乳の品質に基づいた数値をすぐに知ることができます。さらに、エンリッチメントで達成したい目標 Brix パーセンテージを設定する必要があります。私たちの目標は、常にBrixが25~30%の間の初乳を得ることです。初乳のBrixパーセンテージ(現在ある初乳の品質)と目標濃縮度(達成したい初乳の品質)が分かれば、表2を参考に母乳に何グラムのSCCLコロストラム・リプリケーサーを添加すればよいかを決めることができます。

表2.新鮮初乳を強化するためのコロストラムパウダーの計算。
適切な初乳管理の基本をおろそかにしてはいけません。
低品質の母牛初乳を強化することは、全ての新生子牛にとって最適で均一なスタ ートとなる実用的かつ効果的な手段です。しかし、理想的な結果を得るためには、適切な初乳管理には一般的に 4 つのポイントに重点を置いたプロトコールを適用することを忘れてはいけません(図 4)。
- 投与のタイミング→最初の2時間以内、2回目の授乳は最初の12時間以内。
- 初乳の質→IgG濃度が50g/L以上。
- 初乳量→体重 10% 相当(kg)の第 1 回給餌+体重 5% 相当の第 2 回給餌。
- コロストラムが清潔であること→病原体負荷または細菌数が少ないこと。
最後に、コロストラムを強化する際には、母体のコロストラムから直接抽出したコロストラム補充剤を使用することが不可欠です。これにより、添加物を加えたり、重要な成分を取り除いたりすることなく、天然初乳の本質的な特徴を維持することができます。適切な代替ミルクは、母体初乳に含まれる脂肪、タンパク質、免疫グロブリン、生物活性化合物の自然なレベルを維持する必要があります。こうすることで、子牛は母牛の初乳から得られるような栄養と免疫保護を受けることができ、健康と発育に最大限の恩恵を受けることができるのです。 

図 4.適切な初乳管理プロトコールのポイント
結論初乳の質は同じ農場内の牛でも大きく異なるため、子牛の栄養を農場の初乳だけに頼ることは困難です。初乳補液は、母牛の初乳の IgG と栄養分を向上させ、より安定し た高品質の初乳を確保できることが証明されている方法です。初乳の質を向上させることで、酪農家は免疫の受動的移行を促進し、疾病の 発生を抑え、罹患率や死亡率を減少させることができます。強化初乳を与えられた子牛は、感染症に対抗する準備が整い、抗生物質の必要量が減り、生存率が高くなります。初乳補充剤への投資は、子牛の健康を促進するだけでなく、獣医学的コストを削減し、長期的な生産を向上させ、より持続可能な酪農産業の発展に貢献します。
参考文献
Bielmann, V., J. Gillan, N.R. Perkins, A.L. Skidmore, S. Godden, and K.E. Leslie.2010.乳牛の初乳品質測定のための Brix 屈折率測定装置の評価。doi:10.3168/JDS.2009-2943.
Conneely, M., D.P. Berry, R. Sayers, J.P. Murphy, I. Lorenz, M.L. Doherty, and E. Kennedy.2013.乳牛の初乳中の免疫グロブリン G 濃度に関連する因子。doi:10.1017/S1751731113001444.
Faber, S.N., N.E. Faber, T.C. Mccauley, and R.L. Ax.2005.ケーススタディ:初乳摂取が泌乳成績に及ぼす影響。Prof Anim Sci 21:420-425. doi:10.15232/S1080-7446(15)31240-7.
Lombard, J., N. Urie, F. Garry, S. Godden, J. Quigley, T. Earleywine, S. McGuirk, D. Moore, M. Bran, M. Chamorro, G. Smith, C. Shivley, D. Catherman, D. Haines, A.J. Heinrichs, R. James, J. Maas, and K. Sterner.2020.米国における乳牛の子牛と牛群レベルの受動免疫に関する合意勧告。doi:10.3168/JDS.2019-17955.
Lopez, A.J., J. Echeverry-Munera, H. McCarthy, A.C. Welboren, A. Pineda, M. Nagorske, D.L. Renaud, and M.A. Steele.2023.新生ホルスタイン子牛の IgG 吸収に及ぼす、コロストラム補充剤による低・中質初乳の IgG 濃度濃縮の影響。J Dairy Sci 106:3680-3691. doi:10.3168/JDS.2022-22518.
McGuirk, S.M., and M. Collins.2004.初乳の生産、保管、出荷の管理。Veterinary Clinics of North America:doi:10.1016/J.CVFA.2004.06.005.
Moore, M., J.W. Tyler, M. Chigerwe, M.E. Dawes, and J.R. Middleton.2005.初乳採取遅延が乳牛の初乳 IgG 濃度に及ぼす影響。J Am Vet Med Assoc 226:1375-1377. doi:10.2460/JAVMA.2005.226.1375.
Murray, C.F., D.M. Veira, A.L. Nadalin, D.M. Haines, M.L. Jackson, D.L. Pearl, and K.E. Leslie.2015.難産が新生ホルスタイン子牛の活力および免疫グロブリンの受動移行に関連する生理学的および行動学的特性に及ぼす影響。Canadian Journal of Veterinary Research 79:109.
Quigley, J.D., A. Lago, C. Chapman, P. Erickson, and J. Polo.2013.牛初乳中の免疫グロブリン G 濃度を推定するための Brix 屈折率計の評価。J Dairy Sci 96:1148-1155. doi:10.3168/JDS.2012-5823.
Robison, J.D., G.H. Stott, and S.K. DeNise.1988.受動免疫が未経産牛の成長と生存に及ぼす影響。doi:10.3168/JDS.S0022-0302(88)79684-8.
Silva, A.P., A.M. Cezar, A.F. de Toledo, M.G. Coelho, C.R. Tomaluski, G.F. Virgínio Júnior, and C.M.M. Bittar.2024.乳牛の子牛への給与において、移行乳と併用する、または併用しない初乳補充剤を添加することによる中質初乳の強化。Sci Rep 14. doi:10.1038/S41598-024-55757-4.
____________________________________________
ルチア・ピゾーニ、ジュリアナ・メルグ・レアン、ホセ・マリア・ロドリゲス イセラ・セバージョス、マリーナ・ゴドイ
カナダ、サスカトゥーン、サスカトゥーン・コロストラム社臨床研究部
