Wprowadzenie
Nowonarodzone cielęta mają słabo rozwinięty układ odpornościowy i nie mają krążących przeciwciał matczynych, co czyni je bardzo podatnymi na choroby zakaźne. W przeciwieństwie do ludzi, u których odporność bierna przenoszona jest przez łożysko, łożysko synepitheliochorialne bydła uniemożliwia transfer immunoglobulin od matki do płodu (Peter, 2013). W rezultacie cielęta rodzą się bez odporności humoralnej i są całkowicie zależne od pobrania siary w celu uzyskania odporności biernej.
Immunoglobuliny i ich rola w odporności cieląt
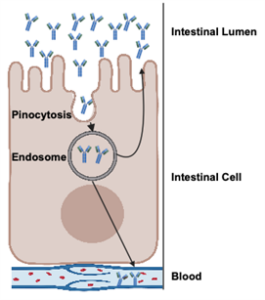
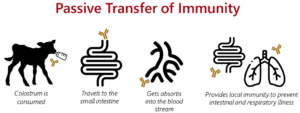
Rysunek 1. Proces wchłaniania immunoglobulin poprzez pinocytozę w komórce jelitowej.
Jaka immunoglobulina?
Chociaż siara zawiera inne immunoglobuliny, takie jak IgM i IgA, IgG jest dominującym przeciwciałem (rysunek 2) i głównym przedmiotem badań ze względu na jego kluczową rolę w odporności biernej. Po wchłonięciu IgG neutralizuje patogeny, wzmacnia opsonizację i wspiera adaptacyjny rozwój odporności (Janeway i in., 2001). Ponadto IgG może być ponownie wydzielana do jelita, przyczyniając się do odporności błon śluzowych wraz z IgA (Besser i in., 1988; Ulfman i in., 2018) (jak pokazano na rysunku 1)
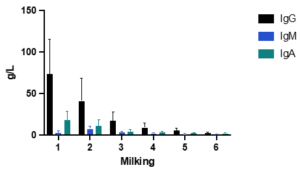
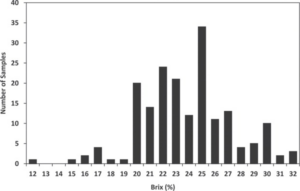
Rysunek 2. Poporodowe stężenia IgG, IgA i IgM dla 6 udojów po wycieleniu w odstępach 12-godzinnych. Dane na podstawie Stott et al. (1981).
Skutki odporności biernej
Efekty krótkoterminowe
Niepowodzenie transferu odporności biernej (FTPI) jest zwykle definiowane jako IgG w surowicy < 10 g/L u cielęcia w wieku od 24 do 36 godzin (Weaver i in., 2000). Stosując ten próg, Raboisson i wsp. (2016) przeprowadzili metaanalizę 10 badań i stwierdzili, że cielęta mleczne z FTPI miały:
- 2,12 razy wyższe ryzyko zgonu
- 1,75 razy wyższe ryzyko chorób układu oddechowego
- 1,51 razy wyższe ryzyko biegunki
- 1,91 razy wyższe ryzyko ogólnej zachorowalności
- Niższy o 81 g/dzień średni dzienny przyrost masy ciała
Łącznie, w oparciu o wyniki badania, szacowany wpływ ekonomiczny FTPI wyniósł $89,27 CAD na przypadek. Podobnie, Abdallah i wsp. (2022) przeprowadzili metaanalizę na cielętach mlecznych niezastępczych (cielęcina lub wołowina mleczna) przy użyciu tego samego progu FTPI (< 10 g IgG / l) i stwierdzili, że dotknięte cielęta miały:
- 2,46 razy wyższe prawdopodobieństwo zgonu
- 3,03 razy wyższe prawdopodobieństwo wystąpienia biegunki
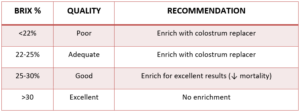
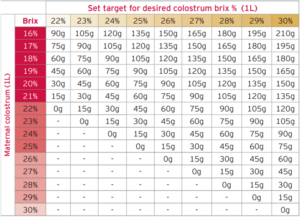
Nowsze badania sugerują, że do zdefiniowania odpowiedniej odporności biernej należy stosować wyższe progi. Lombard i wsp. (2020), w drodze konsensusu ekspertów, doszli do wniosku, że tradycyjny próg odcięcia 10 g / l jest zbyt niski i że osiągnięcie wyższych poziomów IgG w surowicy ma kluczowe znaczenie dla optymalnego zdrowia cieląt. Zalecane progi dla stężenia IgG w surowicy, białka całkowitego i Brix % przedstawiono w tabeli 1.
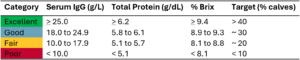
Tabela 1. Konsensusowe stężenia IgG w surowicy, białka całkowitego i Brix % wraz z sugerowanymi celami przez Lombard i wsp. (2020).
Wiele badań potwierdziło korzyści płynące z osiągnięcia wyższych progów odporności biernej. Sutter i wsp. (2023) przeanalizowali dane dotyczące białka całkowitego w surowicy od 3434 cieląt mlecznych, od których pobrano próbki w wieku od 2 do 7 dni na komercyjnej farmie mlecznej. Stwierdzili, że cielęta z doskonałą odpornością bierną (w porównaniu ze słabą) miały:
- 50% niższe ryzyko chorób układu oddechowego
- 50% niższe ryzyko ogólnej zachorowalności
- 60% niższe ryzyko śmiertelności
- Wyższy o 0,04 kg/dzień średni dzienny przyrost masy ciała
Podobne wyniki uzyskali również Crannell i Abuelo (2023). Analizując zapisy dotyczące białka całkowitego w surowicy od 4 336 cieląt mlecznych pobranych w wieku od 2 do 7 dni w komercyjnym gospodarstwie mlecznym, stwierdzili, że cielęta z doskonałą odpornością bierną (w porównaniu ze słabą) miały:
- 33% niższe ryzyko wystąpienia biegunki
- 28% niższe ryzyko chorób układu oddechowego
- 34% niższe ryzyko ogólnej zachorowalności
- 77% niższe ryzyko śmiertelności
Efekty długoterminowe
Niewiele badań dotyczyło długoterminowego wpływu odporności biernej. DeNise i wsp. (1989) przeanalizowali poziomy IgG w surowicy u 1000 cieląt, od których pobrano próbki w wieku od 24 do 48 godzin i stwierdzili, że na każdy 1 g/L wzrostu IgG, wydajność mleka w pierwszej laktacji wzrastała o 8,5 kg. Dodatkowo, cielęta z IgG < 12 g/L miały najwyższe wskaźniki uboju z powodu niskiej produkcji w pierwszej laktacji i zwiększonej śmiertelności od urodzenia do 180 dni.
Niedawno Crannell i Abuelo (2023) zastosowali progi odporności biernej Lombard et al. (2020) i stwierdzili, że cielęta w kategorii doskonałej (vs. słabej) miały:
- 2,78 razy wyższe ryzyko zapłodnienia
- 2,22 razy wyższe ryzyko zajścia w ciążę jako jałówka
- 1,32 razy wyższe ryzyko wycielenia po raz pierwszy
Podobnie Faber i wsp. (2005), choć nie mierzyli bezpośrednio IgG, stwierdzili, że cielęta karmione 4 l siary po urodzeniu produkowały 955 kg więcej mleka w pierwszej laktacji i 1 652 kg więcej w drugiej laktacji w porównaniu do tych, które otrzymywały 2 l siary.
Wyjście poza odporność bierną
Chociaż głównym przedmiotem zainteresowania były IgG i odporność bierna, siara zawiera wiele bioaktywnych związków, które wpływają na rozwój układu odpornościowego i zdrowie jelit (Blum i Hammon, 2000; Fischer-Tlustos i in., 2021). Karmienie siarą wkrótce po urodzeniu wspiera wczesną kolonizację drobnoustrojów, promując korzystne bakterie przy jednoczesnym zmniejszeniu potencjalnych patogenów (Malmuthuge i in., 2015). Ponadto Fischer-Tlustos i wsp. (2020) stwierdzili, że wcześniejsze spożycie siary poprawiło wysokość kosmków i głębokość krypt, zwiększając powierzchnię wchłaniania składników odżywczych. Podczas gdy IgG jest często podkreślane, jego korzyści mogą być ściśle związane z innymi bioaktywnymi składnikami, które przyczyniają się do ogólnego zdrowia cieląt.
Wiadomości na wynos
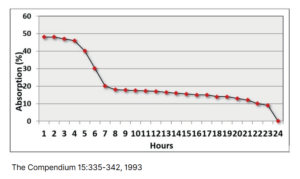
Siara jest niezbędna dla odporności cieląt, ponieważ noworodki rodzą się bez przeciwciał matczynych i polegają całkowicie na pasywnym transferze w celu ochrony. Ponieważ wchłanianie IgG szybko spada, ze znacznie zmniejszoną przepuszczalnością po 12 godzinach, terminowe karmienie siarą ma kluczowe znaczenie. Wyższa odporność bierna poprawia krótkoterminowe zdrowie, zmniejszając ryzyko śmiertelności, chorób układu oddechowego i biegunki, jednocześnie zwiększając wzrost. Długoterminowe korzyści obejmują lepszą wydajność mleczną w pierwszej laktacji, niższe wskaźniki uboju i lepszą wydajność reprodukcyjną. Najnowsze badania sugerują, że tradycyjny próg IgG 10 g/L jest zbyt niski, a osiągnięcie wyższych poziomów odporności biernej jest konieczne dla optymalnego zdrowia i wydajności. Zapewnienie cielętom wystarczającej ilości wysokiej jakości siary natychmiast po urodzeniu ma zasadnicze znaczenie dla ich zdrowia, wzrostu i długoterminowego sukcesu.
Dave Renaud, DVM PhD, profesor nadzwyczajny, Uniwersytet w Guelph
Referencje
Abdallah A, Francoz D, Berman J, Dufour S, Buczinski S. Związek między transferem odporności biernej a zaburzeniami zdrowotnymi u cieląt mlecznych z wielu źródeł hodowanych na cielęcinę lub do innych celów: Przegląd systematyczny i metaanaliza. Journal of Dairy Science. 2022 Oct 1;105(10):8371-86.
Besser TE, Gay CC, McGUIRE TC, Evermann JF. Odporność bierna na zakażenie rotawirusem bydła związana z przenoszeniem przeciwciał surowicy do światła jelita. Journal of Virology. 1988 Jul;62(7):2238-42.
Blum JW, Hammon H. Wpływ siary na przewód pokarmowy oraz na parametry żywieniowe, endokrynologiczne i metaboliczne u nowonarodzonych cieląt. Livestock Production Science. 2000 Oct 1;66(2):151-9.
Crannell P, Abuelo A. Porównanie morb
DeNise SK, Robison JD, Stott GH, Armstrong DV. Wpływ odporności biernej na późniejszą produkcję u jałówek mlecznych. Journal of dairy science. 1989 Feb 1;72(2):552-4.
Faber SN, Faber NE, McCauley TC, Ax RL. Studium przypadku: wpływ spożycia siary na wydajność laktacyjną 1. The professional animal scientist. 2005 Oct 1;21(5):420-5.
Fischer-Tlustos AJ, Lopez A, Hare KS, Wood KM, Steele MA. Wpływ zarządzania siarą na przenoszenie odporności biernej i potencjalną rolę bioaktywnych składników siary na rozwój i metabolizm noworodków. Canadian Journal of Animal Science. 2021 Feb 24;101(3):405-26.
Janeway Jr CA, Travers P, Walport M, Shlomchik MJ. Dystrybucja i funkcje izotypów immunoglobulin. In Immunobiology: The Immune System in Health and Disease. 5th edition 2001. Garland Science.
Lombard J, Urie N, Garry F, Godden S, Quigley J, Earleywine T, McGuirk S, Moore D, Branan M, Chamorro M, Smith G. Consensus recommendations on calf-and herd-level passive immunity in dairy calves in the United States. Journal of Dairy Science. 2020 Aug 1;103(8):7611-24.
Malmuthuge N, Chen Y, Liang G, Goonewardene LA. Karmienie siarą poddaną obróbce cieplnej promuje kolonizację korzystnych bakterii w jelicie cienkim nowonarodzonych cieląt. Journal of dairy science. 2015 Nov 1;98(11):8044-53.
Peter AT. Łożysko bydlęce: przegląd morfologii, składników i wad z perspektywy terminologicznej i klinicznej. Theriogenology. 2013 Oct 15;80(7):693-705.
Raboisson D, Trillat P, Cahuzac C. Niepowodzenie biernego transferu immunologicznego u cieląt: Metaanaliza konsekwencji i ocena skutków ekonomicznych. PloS one. 2016 Mar 17;11(3):e0150452.
Stott GH, Marx DB, Menefee BE, Nightengale GT. Transfer immunoglobulin do siary u cieląt I. Okres wchłaniania. Journal of dairy science. 1979 Oct 1;62(10):1632-8.
Stott GH, Fleenor WA, Kleese WC. Stężenie immunoglobulin kolostralnych w dwóch frakcjach pierwszego udoju po porodzie i pięciu dodatkowych udojach. Journal of dairy science. 1981 Mar 1;64(3):459-65.
Sutter F, Venjakob PL, Heuwieser W, Borchardt S. Związek między transferem odporności biernej, zdrowiem i wydajnością cieląt płci żeńskiej od urodzenia do odsadzenia. Journal of Dairy Science. 2023 Oct 1;106(10):7043-55.
Ulfman LH, Leusen JH, Savelkoul HF, Warner JO, Van Neerven RJ. Wpływ bydlęcych immunoglobulin na funkcje układu odpornościowego, alergie i infekcje. Frontiers in nutrition. 2018 Jun 22;5:52.
Weaver DM, Tyler JW, VanMetre DC, Hostetler DE, Barrington GM. Bierny transfer immunoglobulin z siary u cieląt. Journal of veterinary internal medicine. 2000 Nov;14(6):569-77.